Qu’est-ce-que l’obésité ?
- Une maladie chronique
- Une épidémie
- Un pb de santé
- Un facteur de risque
- un excès de masse grasse
Un handicap
Définition
Maladie caratérisée par une accumulation de graisse corporelle excessive et anormale
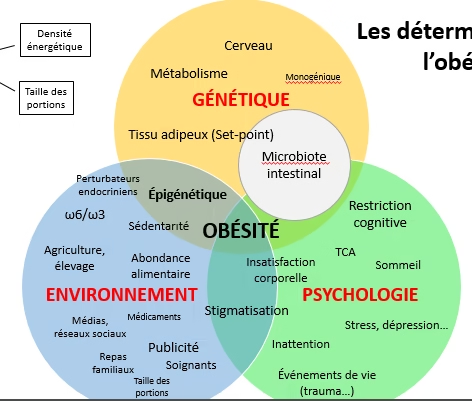
- Fréquente, chronique et évolutive
- Liée à l’environnement et aux modes de vie
- Favorisée par une prédisposition génétique
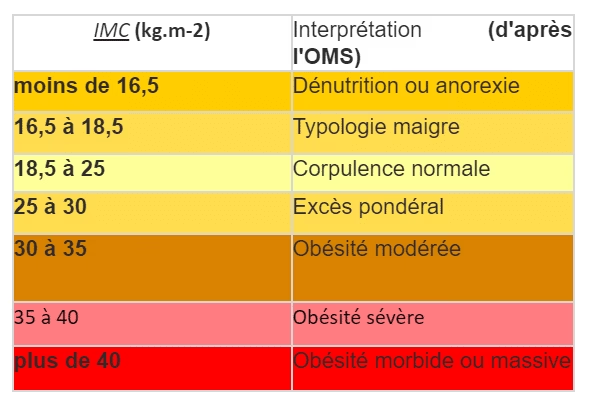
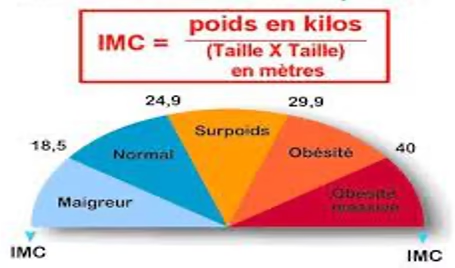
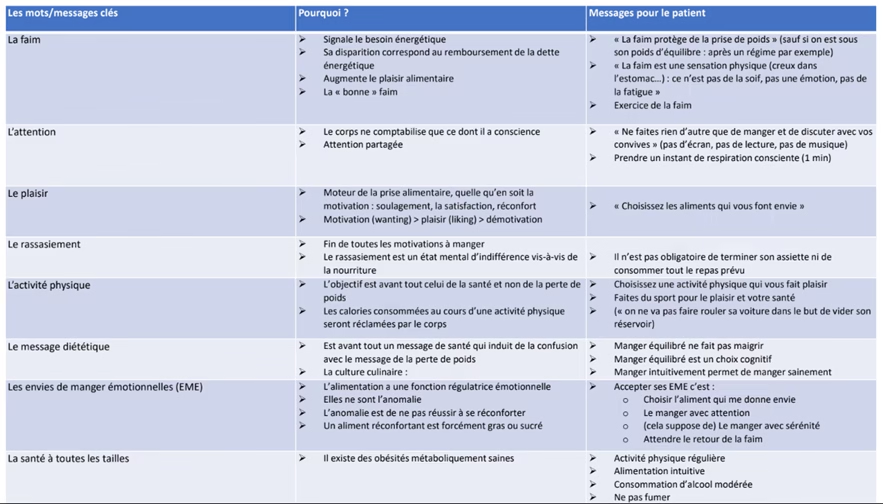
Obésité autrefois défini que par l’IMC mais insuffisant car 2 personnes peuvent avoir le même IMC et pas les mêmes symptômes. On distingue :
- L’obésité clinique
- L”obésité pré-clinique : excès d’adiposité par mesure directe directe de la masse grasse, tour de taille, IMC, âge, sexe, origine ethnique
Les complications
- Maladies cardiovasculaires
- Anomalies métaboliques et endocriniennes
- Troubles pelvi-périnéaux
- Cancer
- Respiratoires
- Complications ostéo-articulaires
- Retentissement psycho-social (dépression souvent associée)
La fonction respiratoire
Physiopathologie respiratoire de l’obésité
- Accumulation de graisse au niveau de l’abdomen et cage thoracique
- Diminution de l’espace pharyngé
Altération restrictive
- Diminution de tous les volumes pulmonaire
- Baisse VRE diminue Capacité vitale
- Augmentation graisse au niveau du thorax -> baisse de la CRF
- Baisse volume
- Déplacement vers le haut du diaphragme : difficulté d’expansion pulmonaire
- Augmentation du travail des muscles inspiratoires
Tolérance à l’effort
- Déclin de la fonction respiratoire -> Augmentation du travail respiratoire -> Augmentation de la consommation O2
Changement du vol pulmonaire
Limmitation du débit expiratoire
Diminution de l’efficacité respiratoire
Altération de la mécanique respiratoire
- FR augmentée-> Effort respiratoire plus important, dyspnée, capacité d’exercice réduite
- Fatigue musculaire inspiratoire pendant l’exercice
- Réduction de la capacité fonctionnelle pendant l’exercice et de la qualité de vie
Obésité et muscles inspiratoires
-> Renforcement des muscles inspiratoires ?
SAOS et SOH
Syndrome d’apnée du sommeil
2 types de syndromes
- Central avec arrêt de l’effort respiratoire
- Obstructif partiel ou complète avec continuité de l’effort respiratoire
Un seul examen diagnostique
- La polysomnographie définit l’IAH (indice apnée hypopnée)
- Diagnstic de SAS dès un IAH=5
- Appareillage si IAH>30 (en France)
Définition
- Apnée obstructive : arrêt du débit aérien naso-buccal pendant au moins 10s avec persistance d’efforts ventilatoires pendant l’apnée (SAOS)
- Hypopnée : diminution de la ventilation pendant au moins 10s s’accompagnant d’une réduction du débit aérien de plus de 50%
- SAOS : épisode répétés de collapsus du pharynx pendant le sommeil, collapsus complet en cas d’apnée, partiel en cas d’hypopnée
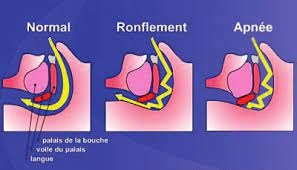
Mécanismes du SAOS
- Prédisposition anatomique
- Déséquilibre entre une charge mécanique et l’activité des muscles dilatateurs des VAS
- Diminution du tonus musculaire
- Augmentation pression tissulaire pharyngée
- Contrôle ventilatoire
Dépistage SAOS
- Présence des critères A ou B et du critère C
- B. Deux au moins des critères suivants :
- Ronflement sé
C. Critères polysomnographiques
Critères de sévérités
- léger : 5<IAH<15 évènement/heure
- Méodéré
- Sévère : IAH>30 évènement/heure
Symptômes du SAOS
Pendant la nuit
- Ronflement sévère et quotidien
- etc
La journée
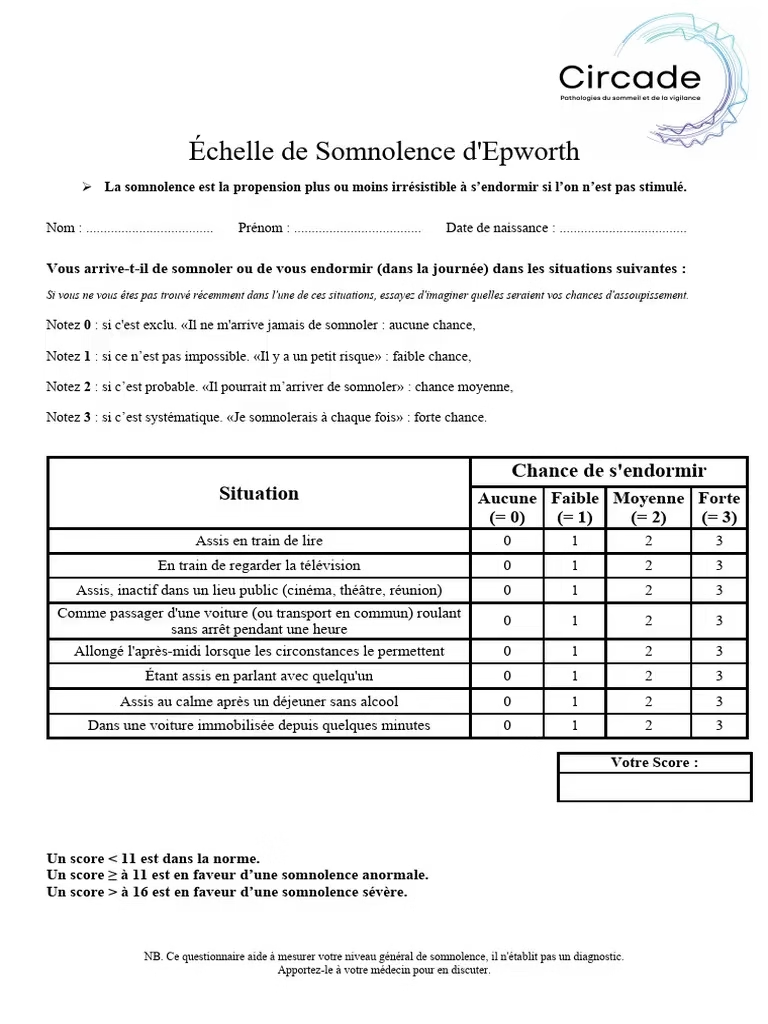
- Somnolence diurne excessive
- Asthénie
- Difficultés à se concentrer, à mémorises
- Troubles de l’humeur, irritabilité
- Trouble llibido
Prévalence du SAOS
- 2 millionsde fraçais
- 2% des femmes et 4% des hommes de 30 à 60 ans
- Plus on monte en âge, plus on est exposé au SAOS
- SAOS augmente avec la sévérité de l’IMC et HTA
Complications
- HTA
- Stress oxydatif
- Risque : AVC, coronapathie, etc
Dépistage
- Diagnostic clinique
- Sy diurnes et nocturne
- Examen clinque, mesure anthropométrique
- Examen ORL : obstacle ou réduction VAS, hypertrophie du palais mou avec hypertrophie de la luette, obstruction nasale
- Examen CV et respiratoire : mesure pression artérielle, FC
- Explorations complémentaires : obésité + SAOS, EFR, gaz du sang (si IMC>35)
- Imagerie des VAS
- Enregistrements nocturnes
Traitement
PEC pluridisciplinaire
- Mesures générales : hygiène de vie
- Traitements spécifiques : chirurgie, orthèse d’avancée mandibulaire, apareil à pression positive continue (PPC), rééducation (kiné linguale, muscle oropharynx, AP régulière)
- Inconvénients PPC : sécheresse des muqueuse, tolérance moindre en cas de rhinites, sensation d’étouffement, image de soi (impact sur le couple), bruit, encombrement, transport, marques sur le visage
- La plupart des arrêt de la PPC se produisent les premières semaines. En moyenne, 15 à 37% des patients abandonnent leur traitement par PPC.
Conséquence de l’arrêt de la PPC
- Reprise des symptômes
- Les comorbidités associées : HTA, troubles du rythme, cardiopathie
SAOS dans l’obésité
- Obésité : important FDR
- Graisse viscérale corrélée à SAOS
- Obésité + SAOS : probabilité de développer diabète type II
Manque de sommeil et poids
Plus le sommeil est réduit, plus le risque d’obésité est important
Perte de poids ne signifie pas diminution des épisodes d’apnée
SAOS léger et modéré : perte de 10% de poids améliore les symptômes
SAOS et chirurgie bariatrique
Diminue la sévérité de l’apnée
En pratique
- SAOS sévère : PPC en 1ère intention, OAM en 2ème si refus PPC
- SAOS léger à modéré : PPC ou OAM
SOH
IMC>30
PaCO2 diurne > 45mmHg (sans autre cause d’hypoventilation)
80% ont également SAOS
SOH associé à une morbi-mortalité importante et coûts de santé élevés
Mécanisme SOH
- Restriction vol pulmonaire
- Diminution compliance thoracique
- Augmentation travail muscles inspi avec coût en O2
- Altération du contrôle des centres respiratoires avec une réponse en CO2 diminuée
- Trouble respi nocturne
- Obstruction pulmonaire
Traitement
En aigu : unité de soins intensifs
Traitement au long cour : VNI
Chirurgie bariatrique risquée chez ces patients
Capacités fonctionnelles et réentrainement à l’effort
Muscle périphérique
Réduction de la masse musculaire, augmentation de la masse graisseuse : perte de force
-> Obésité sarcopénique (risque CV)
| Masse musculaire | Force | Performance physique |
| Anthropométriques TDM IRM | Handgrip F/E genou |
Faiblesse musculaire -> cadence de marche plus lente -> problème de mobilité -> perte d’autonomie
TDM6 : 300m (normalement 600m)
Obésité et risque cardio-vasculaire
- HTA
- Hypertrophie ventriculaire gauche
- anomalie du métabolisme lpidique
- Intolérance au glucose
- Diabète
- Atherosclérose coronarienne
- AVC
Métabolisme et dépense énergétique
- De repos (métabolisme de base) : consommation O2 plus élévée au repos
- Pour l’activité physique : 15 à 30% pour une AP importante
Obésité et activité physique
Consommation d’O2 plus importante pour les patients en situation d’obésité
Plus l’obésité est sévère, plus la diminution d’AP est importante et plus la durée d’AP quotidienne diminue
Facteurs limitant l’AP
- Articulaires (perte de souplesse, douleur)
- Métabolisme et musculaire : perte musculaire, diminution de la tolérance à l’effort, diminution O2 aux muscles en activité)
- Respiratoire (dyspnée, FR élevée)
- Cardiovasculaire
PEC pour AP
Epreuve d’effort simple : 60 à 70% de la FCmax
Absence d’épreuve d’effort : formule de Karnoven : zone de la FC cible = FC réserve x %souhaité + FC repos (FC réserve = FCmax – FCrepos)
- Intensité déterminée en fonction des capacités aérobies et contraintes orthopédique
- Activité à risque traumatologique faible
- Durée 30mn/j (150mn/semaine)
- Intensité modérée : 50-70% de la puissance max
- 5 à 7 fois/semaine
Recommandation HAS
Aérobie + renforcement
Perte de poids en AP : pour une durée et une intensité importante
Conclusion
- REE adapté au patient
- Intensité modérée continue
- HIIT, seulement après évaluation du risque CV et supervisé
- Adapté au cas par cas
REE et chirurgie bariatrique
- Meilleure condition pour l’opération et augmentation masse musculaire
- Post-op : réduction de la perte de masse musculaire, bien-être
- Maintenance : endurance, maintien masse musculaire, bien-être
Troubles pelvi-périnéaux
L’incontinence urinaire
- Fuite involontaire avec impact social
- 3M de femmes de toute âge affectées
- Beaucoup de facteur à l’origine : chirurgie pelvienne, accouchement, obésité
Types d’incontinence urinaire
- D’effort
- Par urgenturie : désir soudain et impérieux
- Urinaire mixte
Hypothèse physiopathologique
Obésité : hyperpression abdominale
Stade d’incontinence urinaire par l’effort
- 1
- 2
- 3
Obésité et IU
L’obésité est associée à une prévalence plus élevée d’IU
Surpoids : augmentation de la pression intra-abdominale -> augmentation de la pression intra-vésicale -> force exercée sur plancher pelvien qui augmente risque IU
Une augmentation de 5 unités d’IMC -> +30% IUE et 15% IUU
Obésité : FDR établie mais causalité sous-jacente pas aussi claire
Physiopathologie
- Augmentation du diamètre sagittal abdominal
- Altération des fibres musculaires et nerveuses du périnée (détrusor)
- Graisse périvésicale
IU en fonction de l’âge
Même si IMC normal à 20 ans, la prise du poids amène au même risque d’IU que quelqu’un avec un IMC déjà élevé
Recommandation de PEC
- Perte de poids modérée réduit symptôme : traitement initial
- Entrainement muscles du plancher pelvien
- Exercice physique
- Chirurgie bariatrique
POP (Pelvic organ prolapse) et IF
Dommage structurel ou dysfonctionnement neurologique dû au stress sur le plancher pelvien en raison de la pression intra abdominale
- Femme en surpoids : 2,5x plus de risque de développer POP
- Obésité pas forcement FDR de prolopasus (rôle controversé)
- Chirurgie bariatrique améliore IU et POP chez femmes obèses
- Pas d’amélioration significative sur l’incontinence fécale et activité sexuelle
- Incontinence fécale fréquence après chirurgie bariatrique, risque de diarrhée
Type de traitement
Conservateur : perte modérée de poids entre 5 et 10% (grade A)
Activité physique
Entrainement des muscles du plancher pelvien en 1ère intention
Rééducation incontinence urinaire et obésité
- PRIDE : Program to Réduce Incontinence by DIet and Exercice (2017)
- Régime hypocalorique et encouragements sur l’AP
- Diminution des épisodes d’IU
- Même sans perte de poids, la rééducation améliore les symptômes
Obésité est un FDR de risque de récidive de POP après hystérectomie : il est donc important d’envisager des modifications du mode de vie : perte de poids, renfo muscles pelviens, AP
Conclusion
Obésité : FDR IU, réversible (chirurgie bariatrique, régime hypocalorique), rééducation périnéale (le plus important)
Place du kiné : stratégie de prévention primaire et secondaire, éducation thérapeutique, rééducation